El auge de la medicina personalizada de precisión (MPP) no supone solo una ardua tarea investigadora, reguladora y de desarrollo farmacéutico. Una vez cumplido todo eso, hay que llegar a la realidad: aplicar las terapias dirigidas a los pacientes correctos.
Esta aplicación asistencial no es sencilla; requiere la adaptación de los centros, de sus circuitos organizativos, de los equipos profesionales y del presupuesto.
No están todos los que son, pero sà son todos los que están. Diario Médico ha planteado cómo se manejan estos cambios para prestar la mejor asistencia a seis centros de referencia en la aplicación de la medicina personalizada, tres públicos y tres privados.
AsÃ, expertos del Complejo Asistencial Universitario de Salamanca, el Hospital Universitario Valle de Hebrón (Barcelona), el Hospital Universitario Gregorio Marañón (Madrid), el Hospital Universitario Fundación Jiménez DÃaz (Madrid), el Hospital Universitario Quirónsalud Madrid y la Fundación de Investigación del Grupo HM Hospitales analizan los cambios que giran en torno a la puesta en marcha de programas de MPP.
Entre sus conclusiones fundamentales, destaca la firmeza en la apuesta por este tipo de terapias, clave de futuro para un alto (y creciente) porcentaje de pacientes. Por ello, la dotación tecnológica imprescindible deberá crecer en los hospitales, con la inversión (y gasto) que eso supone.
Por ello, además de la necesaria incorporación de nuevos perfiles profesionales (bioinformáticos, genetistas), los expertos reclaman más estudios que avalen, por un lado, los resultados clÃnicos de estas terapias aplicadas a los pacientes correctos y, por otro, su coste-efectividad, considerando para ello todos los factores de impacto, tanto costes directos como indirectos.
¿Por qué es necesario (si lo es) virar hacia la medicina de precisión?
Está claro que sà es necesario este viraje, según concuerdan todos los hospitales consultados. De hecho, “no sólo es necesario sino que, a medida de que dispongamos de marcadores especÃficos, resultará imprescindible para proporcionar una asistencia más eficaz, evitando consumo de recursos innecesarios y centrada exclusivamente en aquellos más adecuados para cada pacienteâ€, sostiene MarÃa Isidoro, responsable de la Sección de Farmacogenética y Medicina de Precisión del Complejo Universitario de Salamanca.
A modo de ejemplo, Raquel Hladun, oncóloga pediátrica del Hospital Valle de Hebrón, de Barcelona, recuerda que “un 20% de los cánceres pediátricos continúan siendo incurables, por lo que existe una urgente necesidad de desarrollar nuevas estrategias de tratamiento basadas en terapias dirigidas que permitan mejorar estos resultados y disminuir las secuelas a largo plazoâ€.
Para ello, el Servicio de OncologÃa y HematologÃa Pediátricas del Valle de Hebrón puso en marcha en 2015 el programa Comik, “cuyo objetivo prioritario es describir la firma molecular de los niños y adolescentes con un cáncer en situación de recaÃda o progresión, buscando posibles dianas terapéuticas que puedan permitir el uso de tratamientos dirigidos, gracias a la realización en la muestra de tumor de técnicas de análisis moleculares complejos de secuenciación masivaâ€.
Complementariamente, se toma una muestra adicional del tumor extraÃdo para implantar en ratones, creando tumores espejos, que reproducen las condiciones en que crece el tumor en el paciente. Una vez implantado el tumor espejo, “se testan diferentes tratamientos en los ratones en función de las dianas que se hayan identificado en el análisis molecular previo. Es una forma de probar nuevas terapias evitando la exposición del paciente a fármacos inefectivos. Desde su implantación, 42 pacientes han sido incluidosâ€.
Este tipo de desarrollos son posibles, por un lado, por “el desarrollo y abaratamiento de las plataformas ómicas, que han generado una ingente cantidad de datos que, entre otras cosas, han permitido identificar un número importante de mutaciones en genes que son utilizados por las células tumorales para crecer, y el desarrollo de fármacos dirigidos especÃficamente a dichas alteraciones genéticasâ€, explica Ãngel Ayuso-Sacido, director cientÃfico de la Fundación de Investigación HM Hospitales.
Por otro lado, afirma, “la generación de grandes cantidades de datos genómicos y clÃnicos, junto con los del entorno del paciente y familiares, ha empujado el desarrollo de nuevas estrategias de análisis de datos, basadas principalmente en algoritmos de inteligencia artificial, que permiten predecir la probabilidad de padecer determinada enfermedad, mejorar el diagnóstico, identificar biomarcadores de sensibilidad a terapias especÃficas y anticipar la respuesta del paciente a ellasâ€.
En este sentido, poder “conocer qué individuos se podrán beneficiar del uso de determinadas terapias, y en qué personas conviene evitar esos mismos tratamientos bien por ineficaces o porque van a producir efectos secundarios o toxicidades graves, conlleva un claro beneficio para el pacienteâ€, sostiene Miguel Urioste, responsable de la Unidad de Genética del Hospital Universitario Quirónsalud Madrid.
Por ello, se avecina un “cambio de paradigma que es necesario porque añade el conocimiento, la tecnologÃa ómica, digital y de los big data, que ya están disponibles, a nuestras herramientas diagnósticas y terapéuticas clásicas, mejorando los resultados y permitiendo que se adopten medidas preventivas en salud, diagnósticos más refinados y tratamientos enfocadosâ€, según Carmen Ayuso, jefa del Departamento de Genética de la Fundación Jiménez DÃaz (Madrid) y directora del Instituto de Investigación Sanitaria del hospital (IIS-FJS).
¿Qué cambios de organización son precisos?
La medicina de precisión abarca tanto el ámbito diagnóstico como el terapéutico. “En el primero, los cambios organizativos se dirigen a disponer de la tecnologÃa y recursos necesarios para poder identificar los marcadores diagnósticos que permiten individualizar la enfermedad en el contexto especÃfico del paciente, mientras que en el ámbito terapéutico es precisa la aplicación de herramientas farmacogenéticas que junto con otro tipo de datos clÃnicos, permitan la elección especÃfica de los fármacos más adecuados en cada casoâ€, describe Isidoro.

Asimismo, según Ismael Buño, director cientÃfico del Instituto de Investigación Sanitaria Gregorio Marañón (Madrid), “es importante optimizar los circuitos para facilitar la realización de las pruebas necesarias en los tiempos que requiere cada situación clÃnica y permitir un tiempo de respuesta rápido y, en todo caso, adaptado a las necesidades del paciente. El médico que indica el tratamiento debe disponer de los resultados necesarios a tiempo para hacerlo adecuadamenteâ€.
Por ello, en su opinión, “de la mayor relevancia es la comunicación entre el profesional experto en la realización de las pruebas diagnósticas y el clÃnico. Muchas veces, el clÃnico que trata al paciente recibe un informe escrito de resultados de pruebas de laboratorio, por ejemplo, de difÃcil interpretación para alguien que no está suficientemente familiarizado con dicha informaciónâ€.
Para mejorar esta comunicación, Buño propone “la realización de reuniones conjuntas de interpretación de resultados, la estructuración de comités multidisciplinares por patologÃa, estrategias que pueden incluso facilitar la generación de un informe conjunto laboratorio-clÃnico, etc., y su adaptación a la realidad del médico/servicio clÃnico peticionarioâ€.
Además, a juicio de Hladun, “el desarrollo de programas de medicina personalizada debe ir de la mano del compromiso de las empresas farmacéuticas para facilitar y asegurar el acceso de los pacientes a nuevas terapiasâ€.
El responsable de la Unidad de Genética de Quirónsalud Madrid eleva más la necesidad de cambios organizativos:“Al contrario de lo que sucede en otros paÃses, en el nuestro no existe un plan nacional que regule la implantación de la medicina de precisión en el SNS. Algunas estrategias nacionales, como las del cáncer, o la de enfermedades raras, sà contemplan algunos aspectos que entran de lleno en el concepto de medicina de precisión, y existen también algunas propuestas autonómicas, pero el desarrollo de estas terapias necesita del compromiso del Gobierno que garantice el apoyo y financiación institucional, un marco normativo claro, que avale la seguridad, los estándares de calidad, la interoperabilidad y el uso compartido de la información, la equidad y la sostenibilidad del sistema sanitarioâ€.
Además, resulta fundamental “la formación de los profesionales en áreas que requieren la confluencia de distintas disciplinas. Una de ellas es la genética clÃnica, que a dÃa de hoy carece aún de programa formativo propio en nuestro paÃsâ€.
Abunda en esta idea Ayuso, que considera como lo más importante “crear la estructura asistencial, dotando de servicios de genética en los centros sanitarios y dotándolos de profesionales correctamente formados, tanto los que están cerca de la cabecera del paciente (genetistas moleculares y clÃnicos -reconociendo la especialidad de genética-, consejeros genéticos y bioinformático) como los que participan desde estructuras transversales o plataformas (informáticos y especialistas en análisis de datos, etc.)â€.
¿Qué tipo de equipos se precisan para estos cambios?
Algo han mencionado ya los expertos sobre las nuevas profesiones que son necesarias, pero además “es imprescindible que los equipos sean realmente multiespecializados, no solo multidisciplinares. Esto es, que existan servicios transversales (genética, anatomÃa patológica, farmacia hospitalaria, sistemas informáticos) que pongan en contacto las necesidades asistenciales de los pacientes y de los distintos especialistas, con las nuevas tecnologÃas y la interpretación de sus resultadosâ€, afirma Ayuso.
En cualquier caso, “los equipos multidisciplinares son claramente la clave para la aplicación de la medicina personalizada, y deben estar constituidos por facultativos clÃnicos formados en este ámbito, y por facultativos pertenecientes a los servicios centrales que proporcionan las pruebas complementarias necesarias para la aplicación de la medicina de precisiónâ€, sostiene la responsable de este modelo asistencial en el Complejo de Salamanca, también coordinadora de la Unidad de Referencia de Enfermedades Raras de Castilla y León.
Hladun lo resume asÃ:“La interpretación de los resultados obtenidos en un programa de medicina personalizada precisa de equipos multidisciplinares formados por anatomo-patólogos, bioinfomáticos, investigadores básicos y traslacionales, oncólogos, cirujanos oncólogos y genetistasâ€.
Eso sÃ, no hay que olvidar que, especialmente en hospitales grandes, “las diferentes herramientas básicas de la medicina de precisión ya forman parte tanto de la investigación aplicada como de la práctica clÃnica habitualâ€, afirma Ayuso. Sin embargo, estas herramientas “van a experimentar un enorme desarrollo en los próximos años, extendiéndose también a áreas de gestión sanitaria. Para ello será necesario consensuar procesos de validación, donde se demuestre que cada una de las técnicas o procedimientos que se quieran implantar en este contexto, sean eficaces además de coste-efectivosâ€.
Además, opina que “la predicción irá adquiriendo un papel relevante, permitiendo reducir costes en prevención. Esto se traducirá en la aparición de unidades especÃficas encargadas del análisis de datos, con perfiles profesionales muy concretosâ€.
En cuanto al diagnóstico molecular, vinculado a tratamientos dirigidos, Ayuso recuerda que “ya forma parte del ecosistema hospitalario en áreas como la oncologÃa. Estas unidades crecerán en protagonismo, a medida que se validen nuevos tratamientos dirigidos. De nuevo, será necesaria la inclusión de perfiles profesionales muy concretos, con altos conocimientos en biologÃa molecular del cáncerâ€.
El uso e integración de todos estos tipos de datos, a los que se suman los procedentes del entorno del paciente, “harán necesario resolver un buen número de problemas éticos, además de diseñar arquitecturas de flujo de datos con alto grado de protección y que se ajusten a la normativaâ€.
¿Es necesario un cambio de cultura?
En este punto llega la primera discrepancia en las respuestas de los expertos. Por un lado, las representantes de los centros de Salamanca y la Jiménez DÃaz se muestran favorables a este cambio.
AsÃ, Isidoro piensa que “se precisa un cambio importante, desde el paradigma clásico de la aplicación de la Medicina en la que todos los pacientes con una misma enfermedad se manejaban con una aproximación protocolaria similar, pasamos a una Medicina en la que el manejo de una misma enfermedad puede ser muy diferente, teniendo en cuenta las caracterÃsticas especÃficas de cada pacienteâ€.
Del mismo modo, Ayuso considera que “la relación médico paciente debe cambiar y enriquecerse con esta nueva visión. Dejar de ser reactiva ante un proceso patológico y transformarse en preventiva o proactiva. Y evolucionar desde la perspectiva biunÃvoca para ser multilateral. Requiere una formación distinta de los profesionales, en salud pública y epidemiologia, en procesos más que en especialidadesâ€.
Sin embargo, Urioste piensa que este cambio ya está superado, dado que “cualquier acto médico aspira a ser preciso. Ya lo dijo Hipócrates: es más importante conocer a la persona que tiene la enfermedad, que la enfermedad que sufre la persona. Los planes de cribado neonatal son medicina de precisión. Los análisis genéticos predictivos de la susceptibilidad al cáncer, a las enfermedades cardiovasculares o a las neurodegenerativas, son medicina de precisiónâ€.
Eso sÃ, “es cierto que se incorporarán masivamente nuevas herramientas que requieren un periodo de adaptación. Técnicas que proporcionan un conocimiento más preciso del individuo, de su constitución genética, del ambiente en el que vive y de sus estilos de vida, y el manejo de un volumen enorme de información que permitirá intervenciones preventivas y terapéuticas en aquellos grupos de pacientes que puedan beneficiarse de ellasâ€.
¿Es un gasto o una inversión?
El asunto de los dineros es uno de los mayores puntos de fricción en cuanto a la introducción de estas nuevas terapias. Sin embargo, los que las utilizan muestran cierto acuerdo en que merecen la pena… con ciertas condiciones:“Indudablemente, si se aplica correctamente es una inversión porque evita gastos en recursos y tratamientos innecesarios y que en múltiples ocasiones generan efectos adversos e incluso fracasos terapéuticos y que pueden llegar a poner en riesgo la vida del paciente. Sin embargo, una aplicación inadecuada, indiscriminada y que no esté basada en información cientÃfica contrastada, supone claramente un incremento del gastoâ€, opina Isidoro.
La representante del Valle de Hebrón lo ilustra con un ejemplo:“En el programa Comik, en el 35% de los niños y adolescentes incluidos con un cáncer incurable hemos identificado una anomalÃa molecular relevante para la que podemos utilizar una terapia dirigida innovadora. Estos resultados son equiparables a los resultados publicados de otros programas de medicina personalizada pioneros a nivel internacionalâ€.
A su juicio, “estos resultados justifican por sà solos el gasto económico de un programa de medicina personalizada. Es esperable que el número de pacientes que se beneficiarán de este tipo de proyectos aumentará de forma exponencial, ya que en determinados pacientes identificamos anomalÃas moleculares para las que hoy no disponemos de un fármaco dirigido, pero para las que en un futuro próximo probablemente sà estén disponibles. Asimismo, en otros pacientes identificamos anomalÃas de las que hoy en dÃa desconocemos su significado, pero que puede que en un futuro descubramos que tienen un importante papel en el desarrollo del cáncer por lo que se convertirán en excelentes dianas terapéuticasâ€.
Ayuso, no obstante, considera que la medicina de precisión tiene tanto de gasto como de inversión:“Es necesario hacer estudios realistas de coste-efectividad. La nueva medicina es costosa. Es una falacia afirmar, de un modo naif, que es solo una inversión sin medir de qué inversión y para conseguir qué fines se trata. Es costosa, como lo fue en su momento la incorporación de las técnicas de imagen. Sin embargo, hoy dÃa nadie se cuestionarÃa si se debe hacer o no una prueba de imagen, y a ello ha contribuido no solo su abaratamiento sino también la mejora de los resultados diagnósticos. Asà también ocurrirá con la medicina personalizada de precisiónâ€.
¿Es la medicina de precisión coste-efectiva?
Ahondando en lo expuesto anteriormente, los expertos reciben esta pregunta con cautela.
AsÃ, Urioste considera “prematuro hacer una evaluación del impacto económico de la medicina de precisión. Su vocación es prevenir la enfermedad y ofrecer una asistencia global, con diagnósticos más exactos y tratamientos más precisos, evitando los efectos no deseados de éstos. Su implantación sin duda conlleva gastos importantes, pero, atendiendo a sus objetivos, cabe pensar que a larga contribuirá a que el sistema sea más efectivo, previendo la enfermedad y evitando gastos innecesariosâ€.
Lo que está claro es que la novedad hace que falten aún estudios de impacto económico. Según Ayuso, “habrÃa que medir su impacto en los distintos procesos, aplicando qué técnicas, y en qué sustratos sanitarios. Y reconocer que los gastos que actualmente se producen por la enfermedad, discapacidad, absentismo laboral, dependencia, cronicidad o mortalidad, los asume la sociedad en su conjunto, las familias, los individuos, incluso las empresas, y las distintas administraciones públicas, mientras que la inversión repercute directa y exclusivamente sobre el sistema sanitarioâ€.
En cualquier caso, tal y como expone Isidoro, “el coste-efectividad dependerá del manejo adecuado. Hay que tener en cuenta, también, el carácter sostenible. Por ejemplo, en el ámbito farmacogenético, el coste de las determinaciones en múltiples ocasiones es muy inferior al coste terapéutico, con lo que el ahorro en fármacos no indicados puede ser muy elevado, sobre todo teniendo en cuenta las nuevas terapias. Por otro lado, las determinaciones genéticas de metabolización de fármacos sólo se realizan una vez y son útiles para la prescripción a lo largo de toda la vida del pacienteâ€.
Se manifiesta en la misma lÃnea el representante del Gregorio Marañón, en cuya opinión “el coste económico es mÃnimo comparado con el coste de los diferentes tratamientos que la aplicación de aproximaciones de precisión permite seleccionar más adecuadamente. Cualquier aplicación de un tratamiento no adecuado a las caracterÃsticas del paciente (además del coste no económico, como efectos secundarios, toxicidad, ingresos innecesarios, etc.) resulta en un gasto muy superior al de la propia realización de las distintas pruebas diagnósticasâ€.
Además, todos coinciden en que el coste de estas aproximaciones va disminuyendo progresivamente. “Más aún, la optimización de la realización de las pruebas (programación de las peticiones, centralización, referencia, etc.) permite el uso optimizado de los equipos y, por tanto, el abaratamiento de las determinacionesâ€, según Buño.
¿Se puede medir el impacto en los resultados en salud?
No todas las evaluaciones de la medicina personalizada han de ser económicas. Los expertos se muestran partidarios de valorar los resultados en salud medidos, por ejemplo, en “las mejoras evolutivas, la disminución de los efectos adversos y el aumento en la seguridad del paciente”, según Isidoro.
Eso sÃ, el primer paso es que los investigadores clÃnicos y traslacionales se adapten “a un sistema de investigación que no se base únicamente en el modelo tradicional, en donde la generación de datos estaba precedida por una hipótesis de trabajo. En este nuevo escenario, aparecerán nuevas hipótesis generadas por datos, que posteriormente habrá que validar de la manera tradicionalâ€, sostiene Ayuso-Sacido.
Y es que, tal y como reconoce Buño, “si bien no es fácil medir el impacto en los resultados en salud, es factible y debe hacerse en el contexto de la valoración de la idoneidad de la implantación de estas nuevas pruebas en los sistemas sanitarios. La aproximación más adecuada debe tener en cuenta los distintos indicadores en la población de pacientes tratados con estas nuevas aproximaciones y compararlos con las observadas en pacientes previos, tratados con las aproximaciones clásicas, ajustando la comparación a los posibles sesgos derivados de los distintos momentos en los que se hace la observaciónâ€.
Más cauto se muestra Urioste, que piensa que, al igual que en el caso del coste-efectividad, “es precipitado determinar en estos momentos el rendimiento de la medicina de precisión. Las diferentes tecnologÃas comienzan tÃmidamente a trasladarse a nuestro ecosistema sanitario, en muchas ocasiones gracias a la colaboración entre el sistema público y las empresas privadas, y en no pocas ocasiones, en el seno de proyectos o planes de investigación financiados por las distintas agenciasâ€.
Por ello, concluye, “necesitamos una mayor perspectiva para hacer una valoración mediamente objetiva del alcance, los pros y contras de la medicina de precisiónâ€.
The post La MPP aterriza en los hospitales appeared first on Diariomedico.com.


 Un detalle que muchos ignoran sobre los conocimientos chinos acerca de la salud es que, durante una enorme parte de su historia, tuvieron prohibidos so pena de muerte todo contacto con cadáveres, por considerarlos impuros. De ahà que la mayorÃa de sus propuestas no pasen de “trasteos superficiales”, haciendo suposiciones tan erradas sobre la fisiologÃa que llegaron incluso a inventarse órganos inexistentes. Tampoco está de más señalar que las agujas de precisión actuales distan mucho ya no de las de hace milenios (burdos punzones de madera), sino de las de la revolución industrial, por lo que poco tenÃan que ver sus tradicionales sesiones con las de hoy en dÃa.
Un detalle que muchos ignoran sobre los conocimientos chinos acerca de la salud es que, durante una enorme parte de su historia, tuvieron prohibidos so pena de muerte todo contacto con cadáveres, por considerarlos impuros. De ahà que la mayorÃa de sus propuestas no pasen de “trasteos superficiales”, haciendo suposiciones tan erradas sobre la fisiologÃa que llegaron incluso a inventarse órganos inexistentes. Tampoco está de más señalar que las agujas de precisión actuales distan mucho ya no de las de hace milenios (burdos punzones de madera), sino de las de la revolución industrial, por lo que poco tenÃan que ver sus tradicionales sesiones con las de hoy en dÃa.






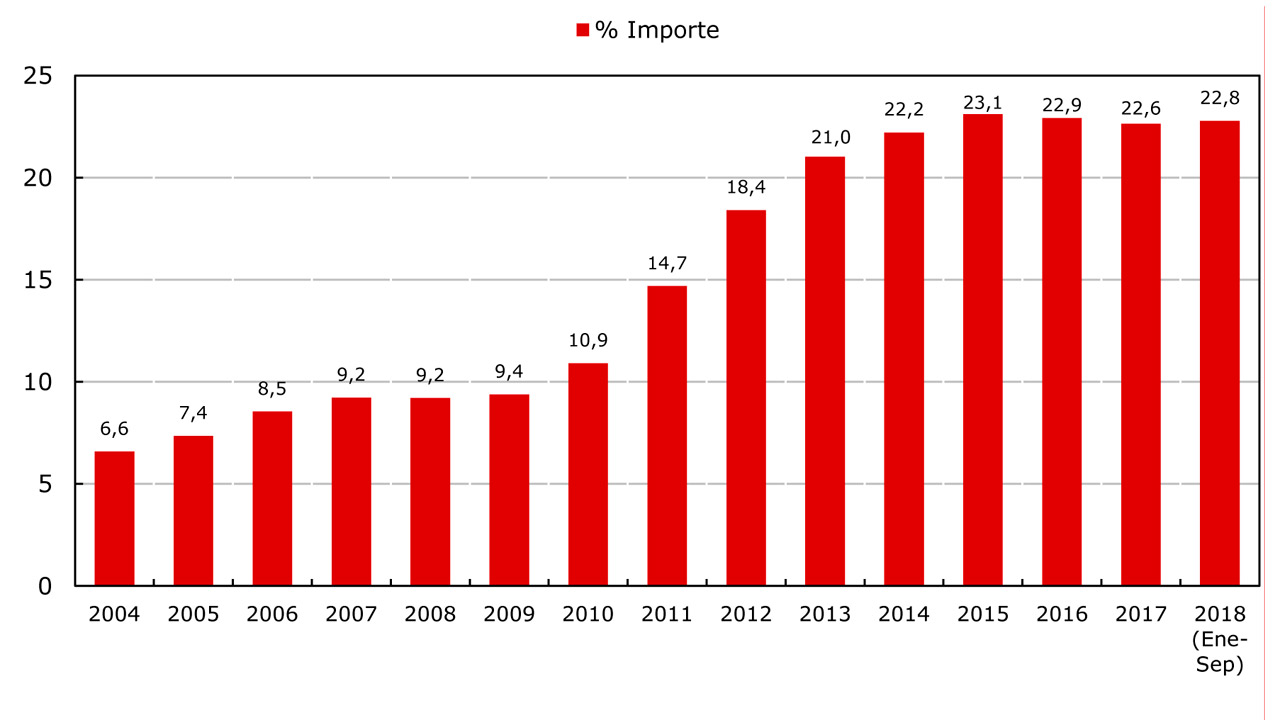












 Varias hipótesis rodean a este incremento: al estilo de vida occidental con mejores condiciones de vida, en general, mayor frecuencia del componente genético, asà como aspectos relacionados con la higiene, y recuerda que no debe confundirse una reacción alérgica, que siempre es inmediata, con una intolerancia, fenómeno muy extendido en los casos de sustancias como el gluten o la lactosa, por ejemplo.
Varias hipótesis rodean a este incremento: al estilo de vida occidental con mejores condiciones de vida, en general, mayor frecuencia del componente genético, asà como aspectos relacionados con la higiene, y recuerda que no debe confundirse una reacción alérgica, que siempre es inmediata, con una intolerancia, fenómeno muy extendido en los casos de sustancias como el gluten o la lactosa, por ejemplo.